

期刊:Acta Neuropathologica
影响因子:9.3
伯豪技术服务:单细胞核转录组测序
科学问题
探究NF2相关神经鞘瘤病(NF2-SWN)中前庭神经鞘瘤(VSs)的分子异质性及其与肿瘤微环境(TME)的关系。
实验材料和方法
免疫组化(IHC)、单细胞核转录组测序(snRNA-seq):70例NF2-SWN患者的77个肿瘤样本本(71例前庭神经鞘瘤VSs,4例三叉神经鞘瘤TSs,2例面神经鞘瘤FNSs),正常神经组织对照
RNA-seq:肿瘤组织
全基因组/外显子测序(WGS/WES):肿瘤及配对血液DNA
单细胞核转录组测序(snRNA-seq):液氮冻存肿瘤组织
导语
NF2相关神经鞘瘤病是一种罕见的遗传性疾病,患者常因双侧听神经瘤导致听力丧失和神经损伤。目前治疗手段有限,临床亟需精准分型和新疗法。北京天坛医院团队在《Acta Neuropathologica》发表突破性研究,首次揭示NF2相关前庭神经鞘瘤存在两种分子亚型:免疫富集型(IES,成人多见/预后较好)和免疫缺失型(IDS,儿童高发/预后较差)。通过多组学分析发现,IES以巨噬细胞浸润为特征且对CSF1R抑制剂敏感,而IDS则富集VEGFA+雪旺细胞,这为NF2精准治疗提供了重要分子分型依据和靶向治疗新策。
主要技术
单细胞核转录组测序
(技术服务由伯豪生物提供)
研究结果
1. 临床研究队列
北京天坛医院团队最新纳入70例NF2-SWN患者(女29例/男41例),均为2012-2021年间接受颅内神经鞘瘤手术的病例。共77个肿瘤样本:前庭神经鞘瘤(VS)71个,三叉神经鞘瘤(TS)4个,面神经鞘瘤(FNS)2个。
转录组分析首次揭示NF2相关神经鞘瘤存在两大分子亚型
通过bulk RNA-seq分析,在所有肿瘤样本中成功鉴定出两个分子亚群(图1a,b)。通过t-SNE降维分析,对6例NF2-SWN患者的13个神经鞘瘤样本(7个前庭神经鞘瘤VSs、4个三叉神经鞘瘤TSs和2个面神经鞘瘤FNSs)进行分子分型解析(图1c),同一患者不同部位的肿瘤始终呈现一致的亚型归属特征,这表明这些肿瘤可能具有相对统一的致瘤机制。
为明确两个分子亚群间的差异,作者基于RNA-seq数据进行了差异基因表达(DGE)和基因集富集分析(图1d)。通过Cytoscape富集图谱可视化显示:一个亚群以免疫相关网络高度活化为特征,另一个亚群则主要表现为细胞增殖和代谢相关信号通路激活,而免疫信号参与极少。基于这些显著的免疫特征差异,我们将NF2-SWN神经鞘瘤划分为"免疫富集型"和"免疫缺失型"两大亚型。
为深入阐明各亚型的生物学特征及致病机制,我们比较了肿瘤组织与正常神经的基因表达谱。免疫富集型(IES)存在1399个上调基因,免疫缺失型(IDS)存在1154个上调基因。KEGG通路分析揭示:两亚型共同富集NF2/Merlin功能缺失相关通路:AMPK信号、Hippo信号、PI3K/Akt信号、TGF-β信号;亚型特异性通路: IES(免疫相关通路显著激活)、 IDS(代谢过程明显增强),这些发现充分验证了NF2-SWN两种分子亚型独特的生物学本质和致病机制。
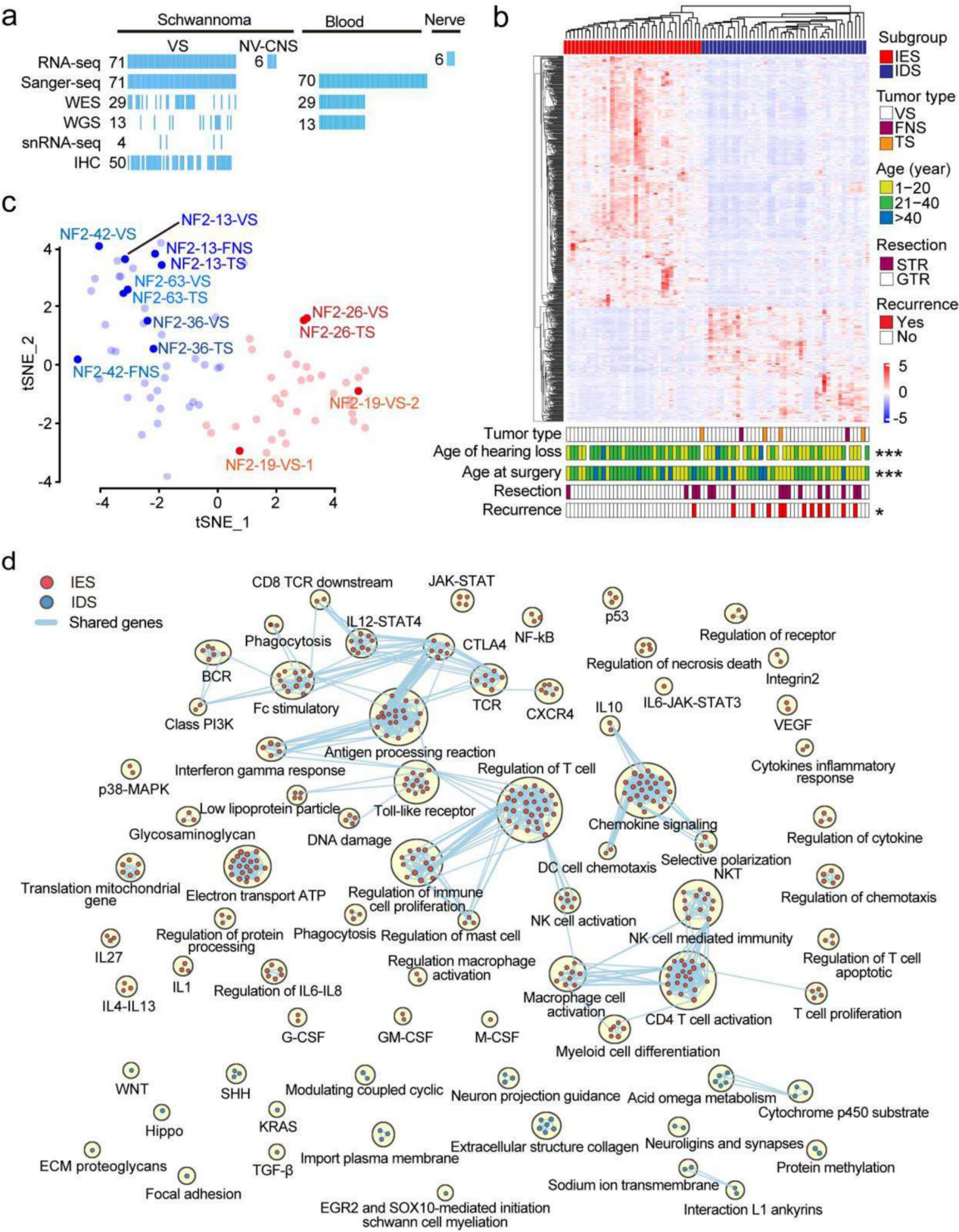
图1 NF2相关神经鞘瘤的转录组图谱解析揭示两种生物学特性迥异的分子亚型
2. NF2相关神经鞘瘤分子分型的临床意义
为明确两个分子亚群间的临床差异,我们对各项临床参数进行了全面比较。分析显示,与免疫富集型(IES)患者相比,免疫缺失型(IDS)患者临床表现更为严重,包括听力丧失发生更早(P < 0.001)、手术时年龄更小(P < 0.001)以及非前庭颅神经鞘瘤发生率更高(P = 0.017)(表1)。此外,IDS患者术前面瘫率(P < 0.001)显著更高,术后面神经功能(P = 0.008)更差(图2a)。多因素logistic回归分析进一步证实IDS与不良术后面神经功能结局存在显著相关性(图2b)。两组在肿瘤大小、分叶状生长、囊性变或切除范围方面未见显著差异。同时,两组均未观察到特定系统性疾病,如自身免疫疾病、严重过敏或特应性疾病等。
随访期间,1例免疫富集型(IES)患者和9例免疫缺失型(IDS)患者出现肿瘤复发(图1b和2c)。7例患者(1例IES和6例IDS)因肿瘤复发或颅/脊神经鞘瘤引起的神经损伤并发症死亡。Kaplan-Meier生存分析显示,IDS组的复发率显著高于IES组(图2d)。与IES组相比,IDS组患者的10年总生存率更差(图2e)。这些结果充分凸显了两个分子亚群截然不同的临床特征,其中IDS与更严重的表型相关。
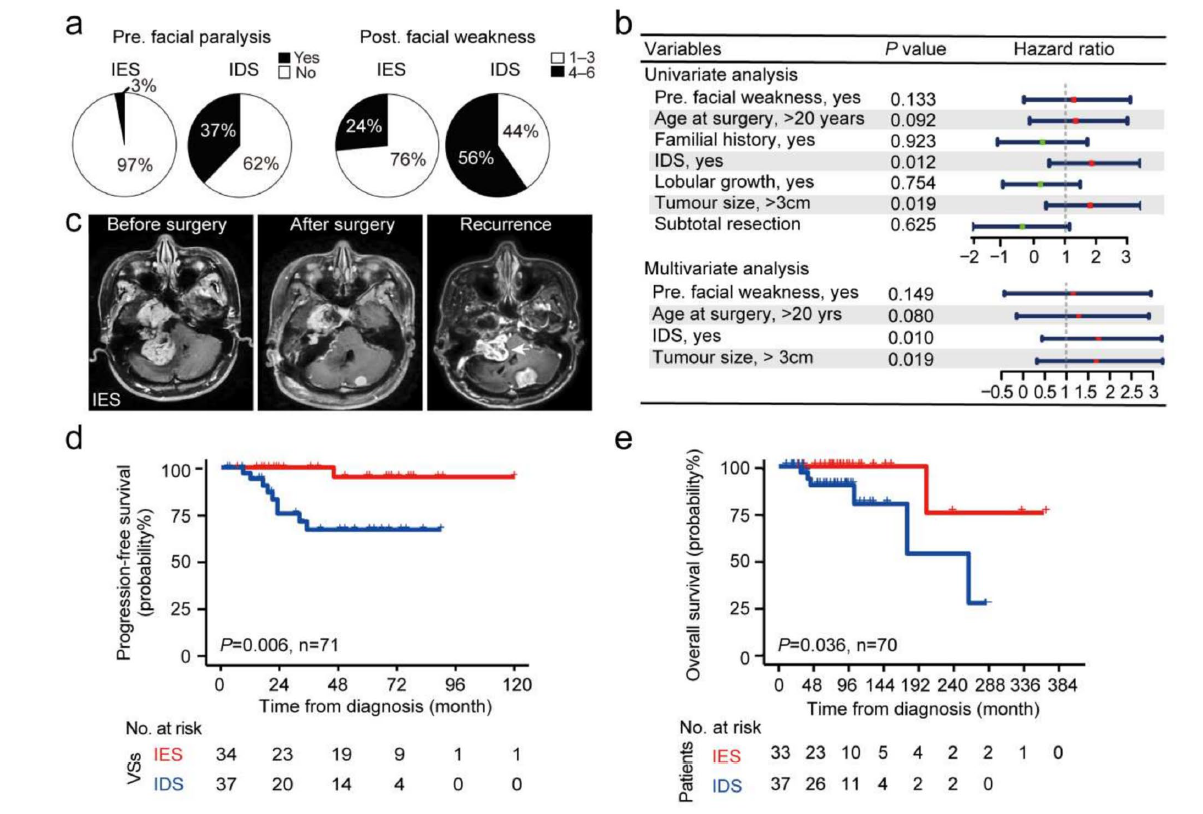
图2 NF2相关神经鞘瘤分子分型的临床相关性
3.NF2相关前庭神经鞘瘤两种分子亚型的差异化遗传学特征
为明确NF2-SWN前庭神经鞘瘤两种分子亚型的遗传学特征,我们采用WGS/WES测序进行了全面遗传分析。结果显示,IES组患者中检出NF2胚系变异的比例为36%(12/33),而IDS组高达92%(34/37;P < 0.001),表明IES组患者可能存在较高比例的嵌合现象。此外,与IDS组(54%)相比,IES组患者截短突变(无义和移码突变)的频率更低(18%)。遗传严重程度评分(Genetic Severity Score)分析显示,IES组患者的严重疾病占比较低(附表1)。
通过对NF2-SWN前庭神经鞘瘤的血液-肿瘤配对样本分析发现:肿瘤体细胞突变以C>T转换为主(图3b),多数病例存在NF2基因杂合性缺失(LOH),CNTNAP3/ZNF717/RNF19B等新型共有突变,以及ATXN1(IES特有)和FCGBP(IDS主导)等亚型特异性突变;显著缺失已知的SOX10/LZTR1等神经鞘瘤相关突变;拷贝数变异分析显示IDS组在3q25/21q/22q等位点缺失更频繁(图3b)。这些差异化的遗传特征为NF2-SWN肿瘤异质性提供了分子基础。
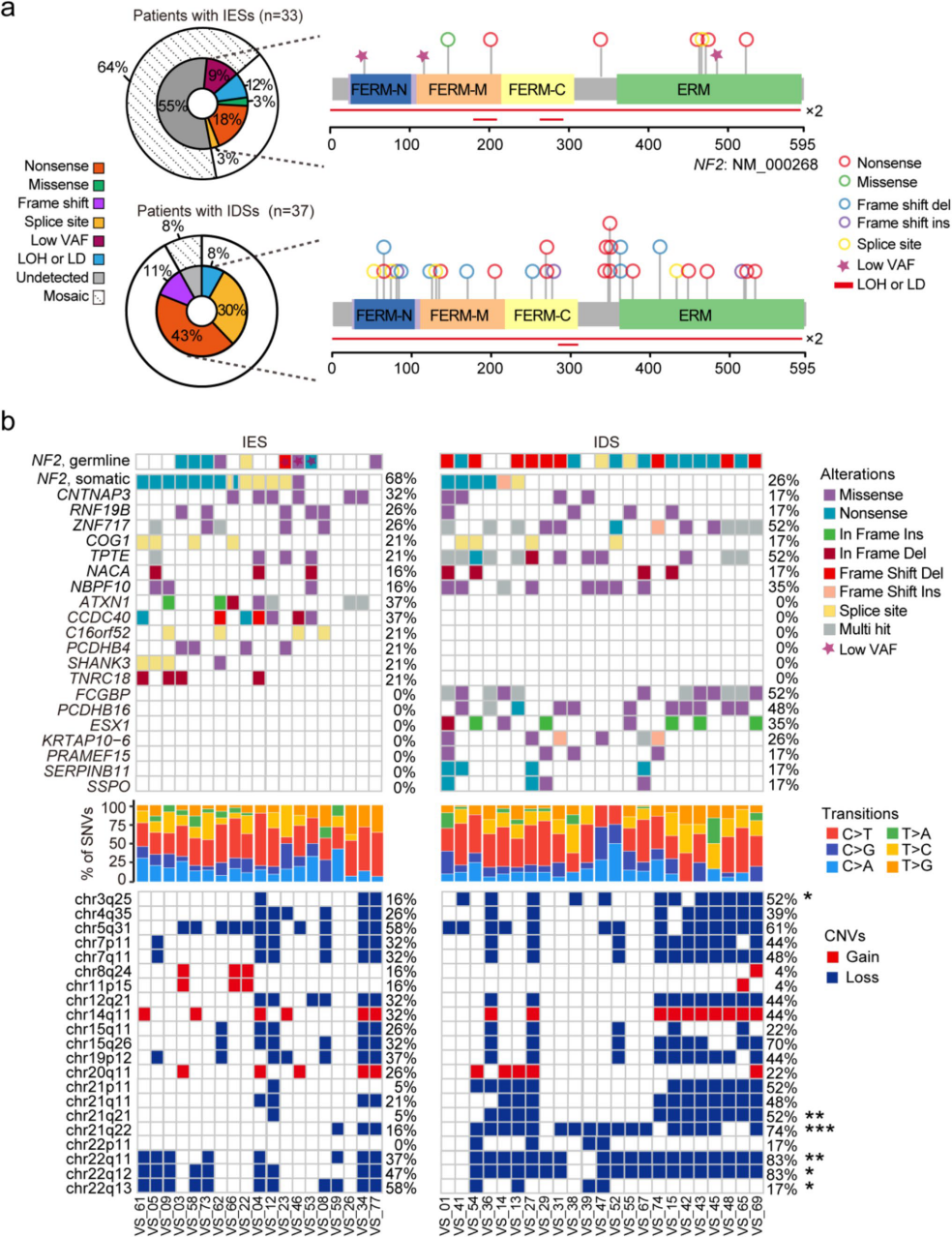
图3 NF2相关前庭神经鞘瘤两种分子亚型的遗传学变异鉴定
4.单核RNA测序分析揭示神经纤维瘤病2型相关前庭神经鞘瘤微环境中的细胞组成多样性
为完善转录组分析并深入解析两个分子亚型的肿瘤微环境(TME)差异,我们对4例NF2-SWN前庭神经鞘瘤(每亚型2例)进行单核RNA测序(snRNA-seq)。40,025个高质量单核数据分析鉴定出18个亚群,10种主要细胞类型(图4a),包括雪旺细胞(SCs)、巨噬细胞(Mφ)、单核细胞(MCs)、T细胞、自然杀伤T细胞(NKT)、MKI67hi前体细胞(PCs)、成纤维细胞(FBs)、内皮细胞(ECs)和平滑肌细胞(SMCs)(图4b)。
雪旺细胞(SC)可进一步细分为六个亚群:PRX+、PTX+、GAP43+、GFRA3+、SLC24A2+和VEGFA+ SCs(图4e)。其中,髓鞘化雪旺细胞(myeSC)簇仅包含PRX+ SC亚群。在免疫富集型神经鞘瘤(IESs)中作为主要亚群的SLC24A2+ SCs,其特征是神经损伤和再生相关通路上调(图4f)。相比之下,VEGFA+ SCs主要存在于免疫缺失型神经鞘瘤(IDSs)中,并表现出与肿瘤血管生成相关通路的激活。
我们进一步对福尔马林固定石蜡包埋(FFPE)样本进行免疫荧光共染色,以评估两组间肿瘤血管生成的差异。结果显示,与IESs相比,IDSs具有更高比例的VEGFA+ SCs和更大的CD31阳性区域(图4g-i)。这表明VEGFA+ SCs可能在血管生成中起重要作用,可能是导致IDSs肿瘤侵袭性生长和不良预后的关键因素。
巨噬细胞可进一步划分为五个亚群:CX3CR1+、SPP1+、TEAD1+、HS3ST2+和NAV-巨噬细胞(图4j)。与雪旺细胞亚群不同,IES和IDS两组间的巨噬细胞亚群比例相似。我们将这些巨噬细胞定义为神经鞘瘤相关巨噬细胞(SAMs)。其中,SPP1+和NAV-SAMs在两组中均占主导地位,其特征是炎症反应相关通路的上调。这表明SAMs可能在NF2-SWN前庭神经鞘瘤的进展过程中通过调控促炎通路发挥作用。
在所有细胞类型中,内皮细胞(ECs)是主要信号接收者,而神经鞘瘤相关巨噬细胞(SAMs)和髓鞘化雪旺细胞(myeSCs)被确定为NF2-SWN前庭神经鞘瘤两个亚型中的主要信号发送者(图4k)。这一发现凸显了血管生成在NF2-SWN前庭神经鞘瘤进展中的重要性。
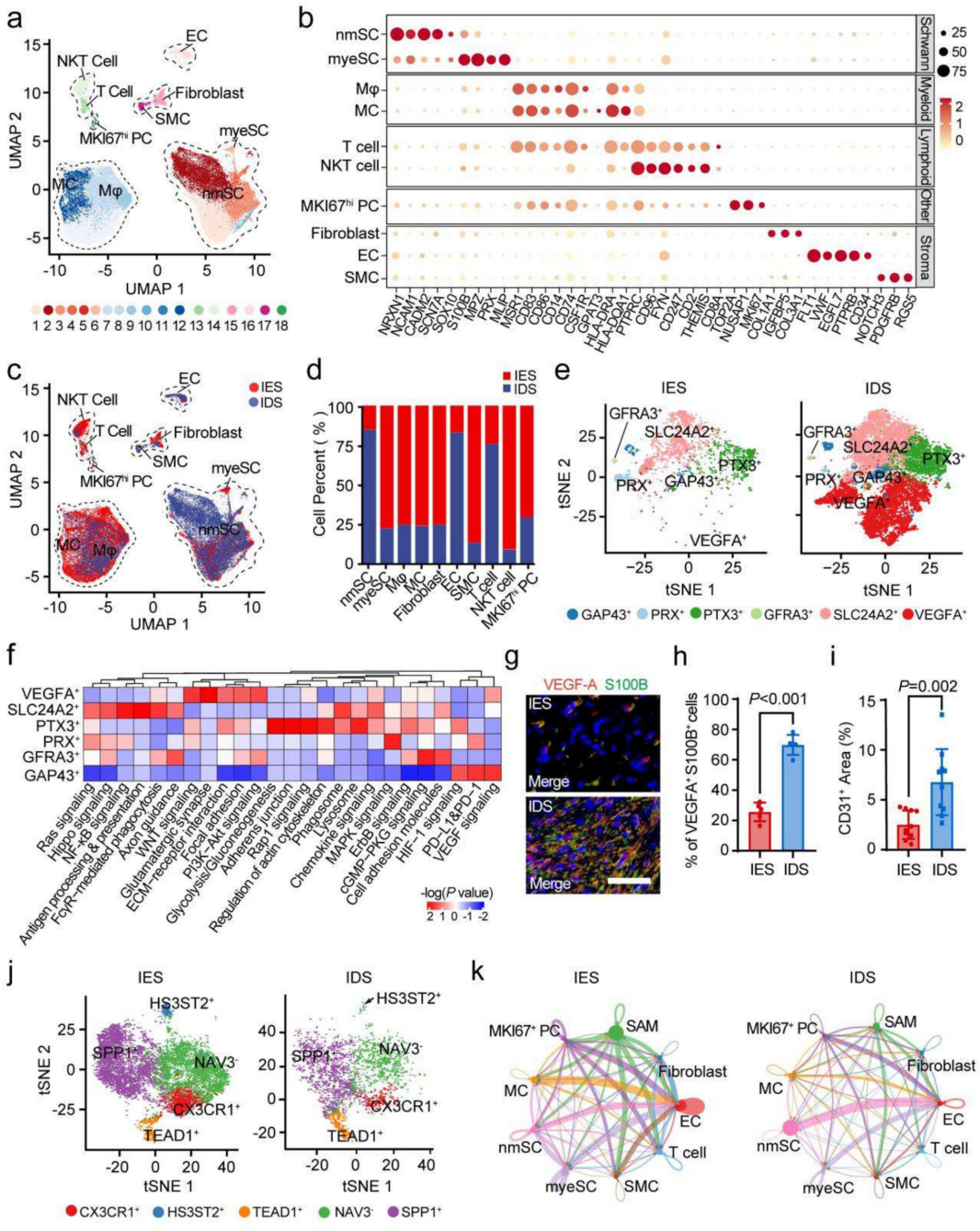
图4 单核RNA测序揭示NF2相关前庭神经鞘瘤两种分子亚型的细胞组成与细胞互作差异
5. NF2/Merlin缺失塑造神经鞘瘤微环境异质性
为验证免疫富集型(IES)与免疫缺失型(IDS)神经鞘瘤中巨噬细胞浸润的异质性,我们对50例福尔马林固定石蜡包埋(FFPE)样本进行了免疫组化染色(标志物:Iba1、CD68和CD163)。研究发现:IES组Iba1+、CD68+和CD163+区域占比均显著高于IDS组(均P<0.001;图5a,b),该结果证实免疫组化可作为区分这两种分子亚型的可靠工具。
为深入探究导致NF2相关神经鞘瘤中SAMs(神经鞘瘤相关巨噬细胞)浸润异质性的潜在因素,我们采用Merlin和Ki-67抗体进行了免疫荧光共染色实验。研究发现,在免疫富集型神经鞘瘤(IESs)中,约80%的Iba1+和CD68+ SAMs表达Merlin蛋白,而在免疫缺失型神经鞘瘤(IDSs)中,这一比例不足5%(图5c,d)。鉴于IDSs患者中NF2胚系突变的高发生率,我们进一步比较了携带与不携带胚系突变的VSs中SAMs的Merlin表达差异,发现携带胚系突变的肿瘤中Merlin+ Iba1+和Merlin+ CD68+ SAMs的比例显著降低。这表明携带NF2胚系致病突变的SAMs可能在NF2相关神经鞘瘤中丧失Merlin表达。此外,我们还观察到IESs中Ki-67+ Iba1+和Ki-67+ CD68+ SAMs的比例显著高于IDSs(图5e,f)。这些数据共同表明,单核/巨噬细胞中的NF2胚系致病突变可能通过影响这些细胞的浸润和增殖能力,从而导致NF2相关前庭神经鞘瘤肿瘤微环境的异质性。
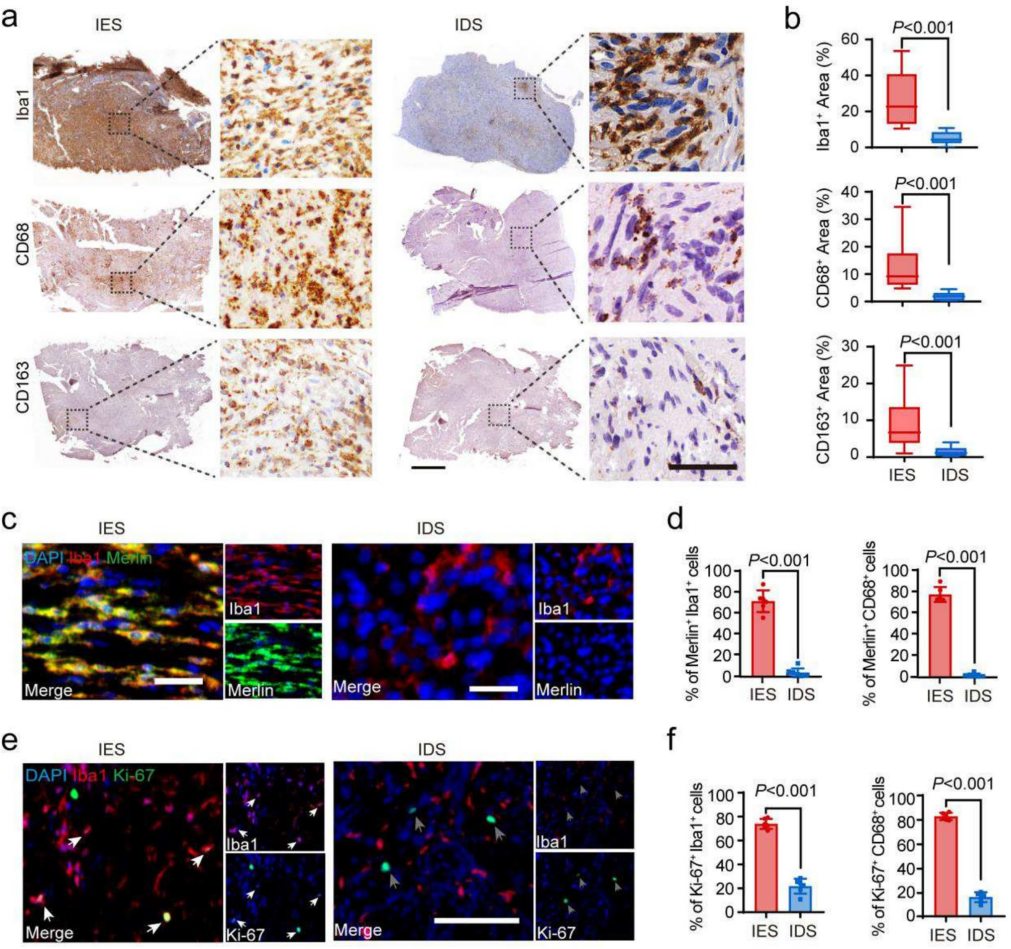
图5 免疫组化染色揭示NF2相关前庭神经鞘瘤中肿瘤相关巨噬细胞浸润的异质性
7.施万细胞(SCs)通过IL34–CSF1R信号轴与肿瘤相关巨噬细胞(SAMs)相互作用
基于单核RNA测序数据,我们发现NF2相关前庭神经鞘瘤中雪旺细胞(SCs)主要通过三条信号轴与肿瘤相关巨噬细胞(SAMs)相互作用:IL34-CSF1R、PROS1-AXL和ANXA1-FPR1(图6a),巨噬细胞亚群高表达CSF1受体(图6b);SCs亚群特异性高表达IL34配体(图6c);CSF1仅在IESs的PRX+ SCs中优势表达。细胞通讯网络分析证实IL34-CSF1R是介导SC-SAM互作的关键通路(图6d/),这为靶向肿瘤微环境提供了新策略。
8.CSF1R信号通路的临床转化价值
转录组分析显示,与正常神经组织相比,NF2相关前庭神经鞘瘤(VSs)中IL34和CSF1R的表达水平显著升高。免疫组化结果证实:CSF1R+区域与Iba1+/CD68+/CD163+巨噬细胞浸润区域呈正相关,IESs中CSF1R表达水平显著高于IDSs,可能表明CSF1R靶向治疗可能产生亚型特异性疗效。
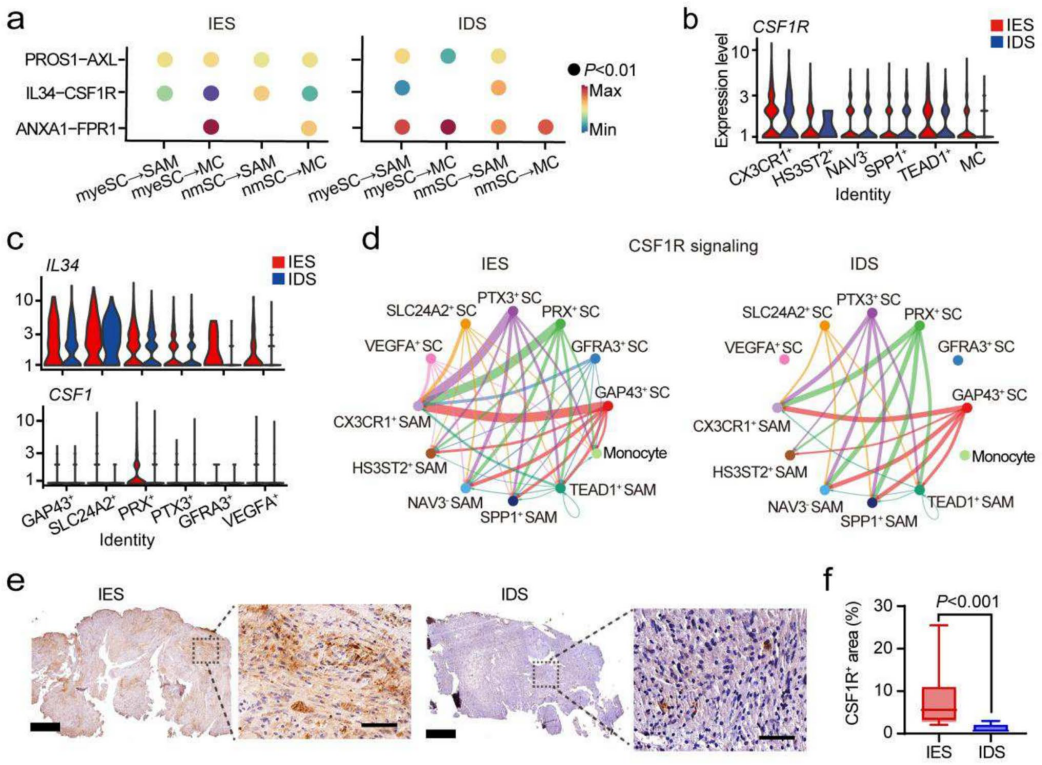
图6 NF2相关前庭神经鞘瘤中雪旺细胞与肿瘤相关巨噬细胞的信号传导机制
结语
这项开创性研究通过多组学整合分析,首次在NF2相关神经鞘瘤中确立了"免疫富集型(IES)"和"免疫缺失型(IDS)"两大分子亚型,不仅揭示了CSF1R/IL34信号轴和VEGFA+雪旺细胞的关键作用,更为临床提供了可操作的分子分型标准和靶向治疗新策略,标志着NF2精准医疗迈入新阶段。
参考文献:
Zhao F, Teng XF, Zhang J, Li SW, Wang LM, Zhao HG, Zhang S, Zhao C, Li P, Zhao XB, Song SH, Liu PN. Multiplatform molecular analyses reveal two molecular subgroups of NF2-related schwannomatosis vestibular schwannomas with distinct tumour microenvironment and therapeutic vulnerabilities. Acta Neuropathol. 2025 May 9;149(1):47. doi: 10.1007/s00401-025-02883-6. PMID: 40343504.
