前言
在细胞命运的体系中,分化(differentiation)是维系生命秩序的关键。正常上皮细胞遵循特定信号完成成熟分化,而当这一程序受阻、细胞停留在“未成熟”状态时,便会脱离组织控制,演变为肿瘤。
在结直肠癌(CRC)中,这一失衡尤为显著。肠道上皮依赖干细胞不断更新,当部分细胞丧失分化能力、长期保持干性(stemness)时,就形成了具有自我更新和多向分化潜能的癌症干细胞(CSCs)。这些细胞是CRC复发、耐药与转移的核心根源。传统化疗或放疗虽能暂时清除增殖细胞,却无法根除CSC群体,因此患者常出现复发。
与传统放化疗不同,分化疗法旨在通过诱导肿瘤细胞重新进入分化轨迹,使其恢复成熟状态、失去无限增殖能力,一直被视为一种极具潜力的策略,尤其是对于结直肠癌(CRC)而言。但这种策略迄今几乎只在血液肿瘤(如急性早幼粒细胞白血病)中成功实现,在实体瘤中长期受限。主要原因在于实体瘤异质性高、分化调控网络复杂且缺乏精确的实验模型。
2025年10月20日,加州大学圣地亚哥分校(UCSD)研究团队在期刊Cell Reports Medicine发表论文“CANDiT: A machine learning framework for differentiation therapy in colorectal cancer”,创新性地提出一种结合人工智能与类器官技术的系统性分化疗法策略。该研究利用机器学习框架 CANDiT(Cancer-Associated Nodes for Differentiation Targeting),在结直肠癌类器官模型中突破性地找到了一个让肿瘤细胞重新分化、并最终自毁的分子开关。激活这个名为PRKAB1的基因后,他们重新唤醒了肠道分化的主调因子 CDX2,从而成功让肿瘤细胞恢复极化、失去干性,并最终走向凋亡。由于该疗法靶向针对肿瘤细胞,而不会影响周围组织,因此可能成为一种比现有治疗方法更安全、更精准的替代方案,有望在未来根治结肠癌。
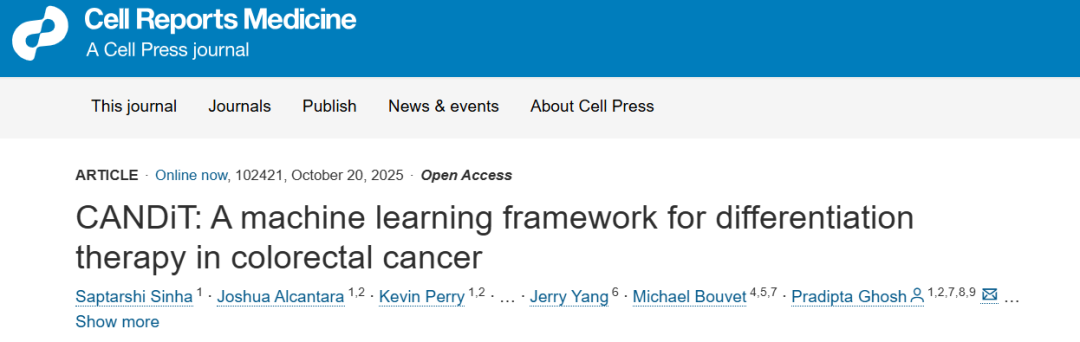
更为重要的是,研究人员介绍道,该结果不只限于CRC领域:“CANDiT 是一个端到端的人类路线图——我们可以将它应用于任何肿瘤,找到正确的靶点,最终瞄准那些一直以来最难定义、追踪或治疗的肿瘤干细胞。通过将小规模类器官研究与临床中大规模的人类多样性数据相结合,我们可以构建严谨、可重复且可扩展的研究发现,同时又不会忽视人类疾病的本质。这种方法改变临床医学的潜力不仅巨大,而且不可阻挡。”
01 从基因网络中寻找“重生键”
“癌症干细胞就像浴室里的肥皂——你刚要抓住它,它又滑走。” 研究负责人、细胞网络医学研究所(iNetMed)教授 Pradipta Ghosh 如此形容。CSC 之所以难缠,是因为它们掌握了改变身份的能力:当周围环境受威胁时,它们能“伪装”成普通肠上皮细胞,避开治疗攻击,等药物退去再度恢复干性。
这场“追踪与逃逸”的战争几乎贯穿所有癌种。团队意识到,如果不能摧毁这种多态性,就无法真正治愈癌症。于是他们转向了机器学习——让算法帮人类识别出细胞命运的弱点。
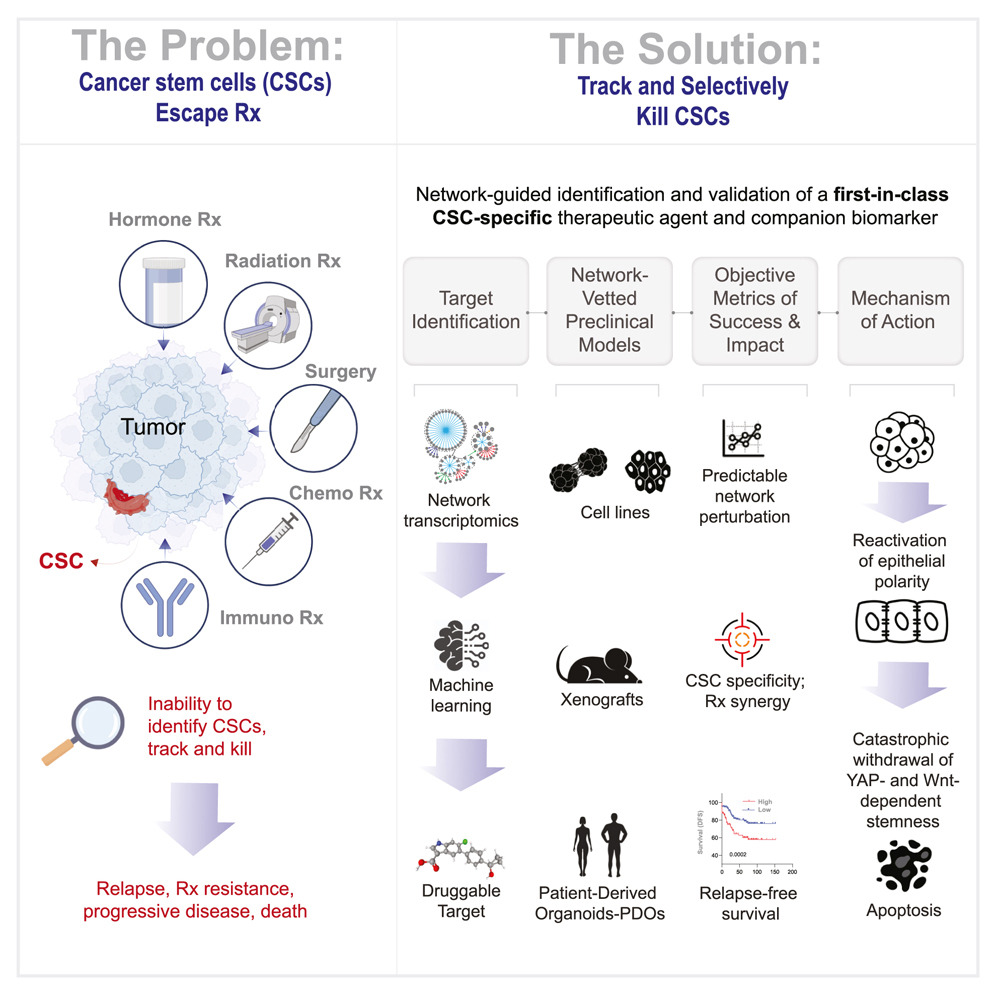
研究团队以布尔推论网络(Boolean implication-based transcriptomic modeling)为理论基础,构建了一个可解析细胞分化轨迹的机器学习平台CANDiT 。CANDiT 的核心目标不是寻找传统意义上能够杀死肿瘤细胞的“致死靶点”,而是通过反向推理,识别可恢复分化程式的“调控中枢”。
在结肠癌中,CDX2的缺失被视为肿瘤去分化的标志。CDX2表达缺陷型肿瘤(CDX2-low)具有更高的干性与更差的生存预后。研究者因此以肠上皮分化主调控因子CDX2为起点,在1662例结直肠癌样本、68 个腺瘤和170个正常组织的转录组中训练模型,试图找出那些与CDX2存在稳定、单向逻辑关系的上游节点。最终,通过网络推理,研究团队锁定了五个潜在上游调控节点,其中PRKAB1(AMPK复合物β1亚基)脱颖而出——它不仅在肠道上皮中高表达,还具有可药物靶向的结构。
PRKAB1编码一种能量感应与细胞极性调节蛋白,长期以来被认为在肠道稳态中发挥核心作用,负责帮助细胞在能量紧张时维持极性与平衡。其在多数结直肠癌中却被沉默。研究者在蛋白质数据库中检索到一款可直接激活PRKAB1的临床级小分子PF-06409577(PF,一种在I期临床中验证安全的AMPK β1特异性激动剂)。CANDiT预测表明,在CSC中激活PRKAB1后,奇迹出现了:
CDX2表达恢复,分化通路复苏,细胞极性恢复,YAP与Wnt信号被压制。最令人震惊的,是那些重新“变好”的细胞最终选择了自毁。第一作者Saptarshi Sinha形容道:“仿佛它们意识到自己失去了肿瘤的身份,无法再存活。”
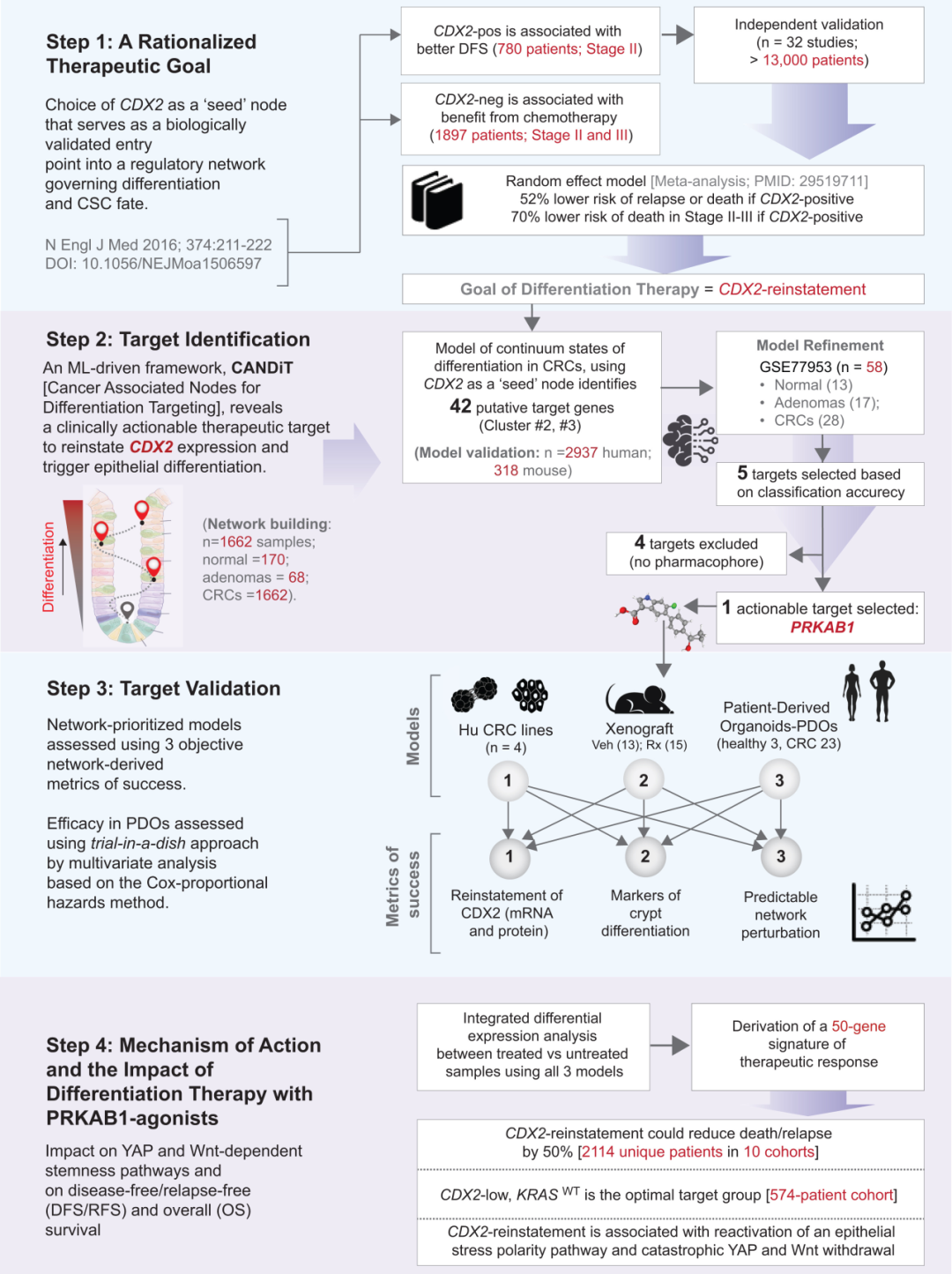
图:研究设计
02 类器官体系验证:分化疗法的精准模型
为了在近似人体生理环境中验证算法推断,研究团队依托UCSD HUMANOID™类器官中心进行了验证。类器官是由患者肿瘤细胞在三维培养体系中自组装形成的“微缩人类组织”,其保留了肿瘤的基因突变谱、极性结构与药物响应特征,是连接实验室发现与临床应用的关键桥梁。而患者来源类器官(PDOs)保留了独属于患者的个性化特征,具有相对更高的体外模拟保真度。
实验中,研究者把PF-06409577应用于多组患者来源类器官(PDOs)。结果显示,在CDX2低表达的PDOs中,PF促使肿瘤腺体重新极化、黏附连接恢复,展现出强效的抗肿瘤活性。转录组测序进一步显示,PF诱导了肠隐窝顶端分化细胞的特征表达(如黏液细胞与吸收细胞标志基因),而肿瘤干性标志物(如ALDH3A1、ASCL2、YAP)显著下降。换句话说,它让肿瘤细胞“想起自己本来是谁”,并在恢复身份的过程中走向自我消亡。
与此同时,健康组织或CDX2高表达类器官则几乎未受影响。也就是说,CANDiT不仅找到了一种“重编程”肿瘤的策略,还天然具备精准性——仅在干性与分化失衡的肿瘤细胞中被重新激活。
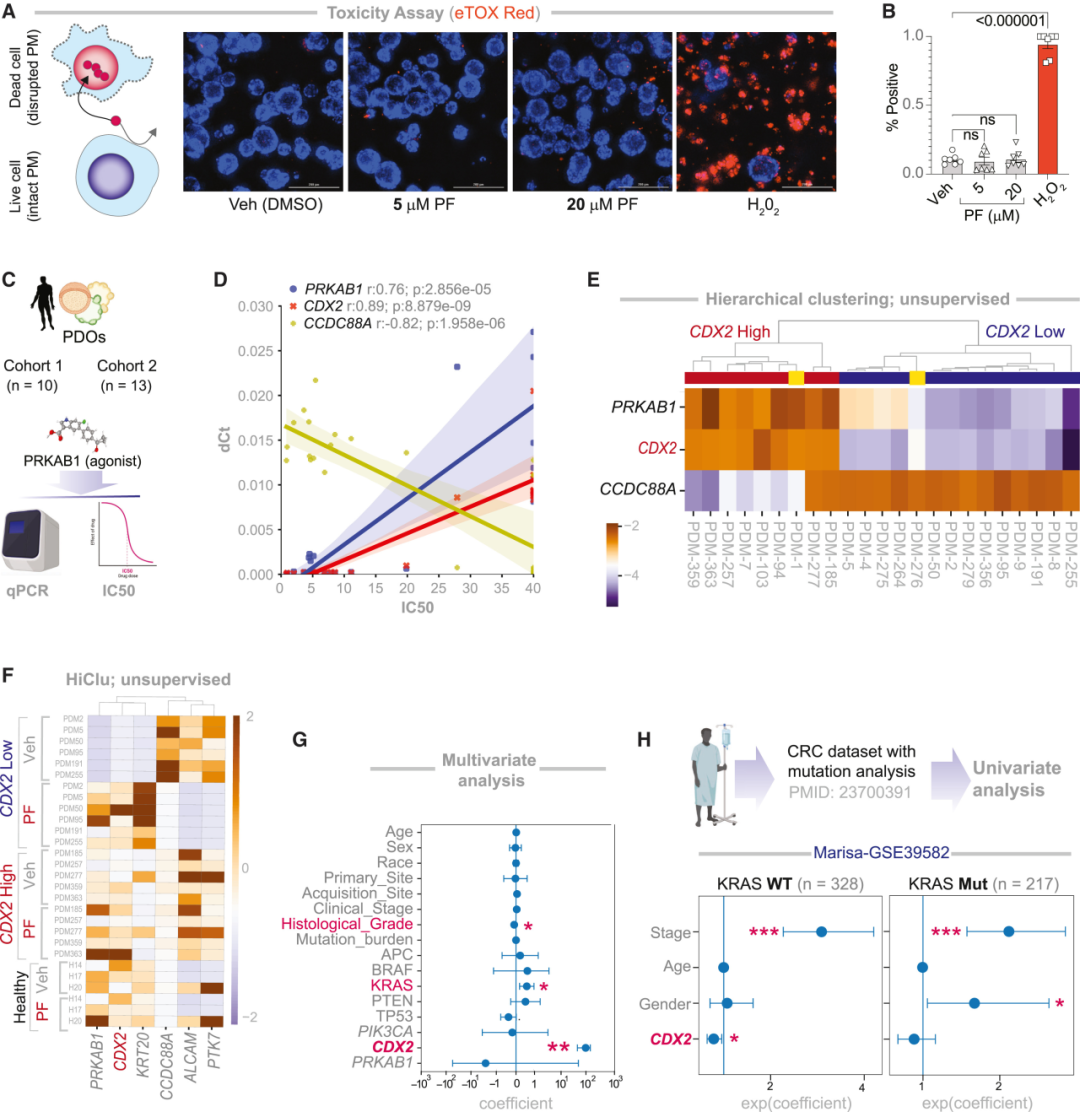
图:PRKAB1 激动剂的分化和抗癌作用仅限于CDX2low PDOs
此外,在异种移植瘤模型中,PF处理使肿瘤体积平均减少68%,存活期延长62.5%,组织学显示分化标志显著恢复。该系列结果证明:通过系统性计算识别并重启分化主控因子,可以在实体瘤中实现功能性“去干化”疗法。
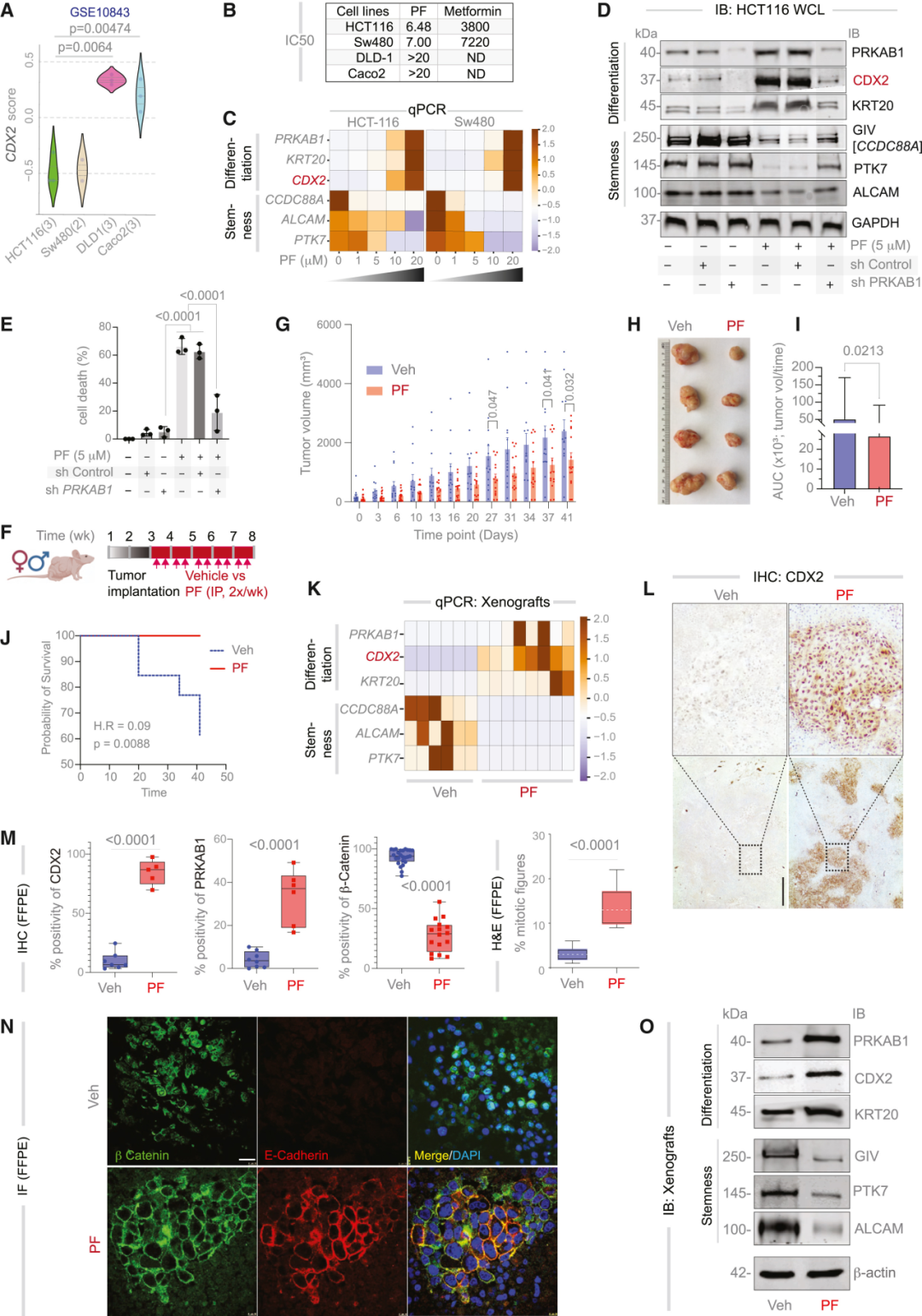
图:CRC细胞系和异种移植模型中的靶点验证
03 跨平台推广与转化前景
CANDiT的意义在于建立了一套可扩展的逻辑框架,可适用于其他实体瘤类型。只需根据不同组织选择相应的谱系主调控基因(例如肝癌中的HNF4A、胰腺癌中的PDX1),便能通过机器学习建立对应的分化网络并反向追溯其上游可药靶点,从而在类器官中验证“重建谱系”的可行性。这一思路让“实体瘤分化疗法”第一次具备了系统性和可预测性,使肿瘤药物发现从高通量随机筛选转向计算推理驱动的靶点重建,可解释性强、成本可控,并能以真实组织体系为基础实现跨患者验证。
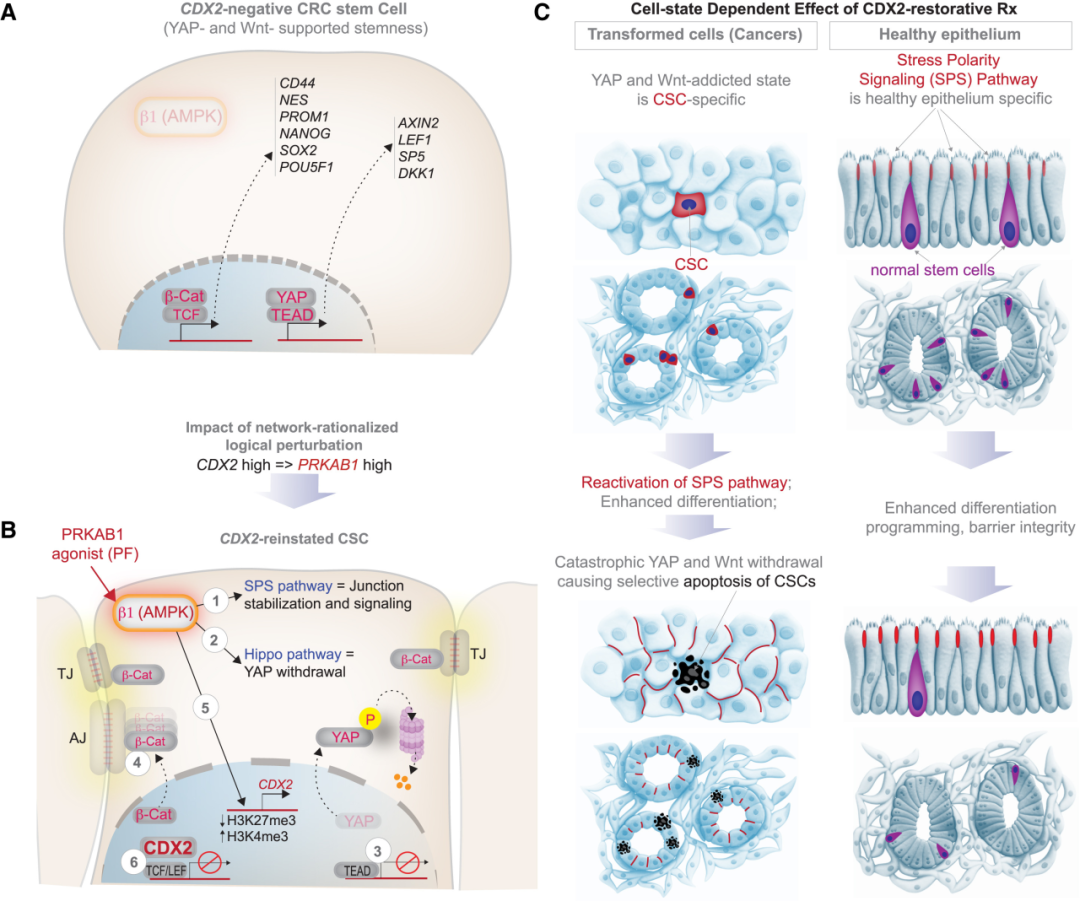
图: CDX2 恢复如何选择性靶向 CRC 干细胞的总结和工作模型
04 类器官引领的肿瘤治疗革命
过去,动物模型常常误导药物筛选,因为它们无法完全重现人类代谢环境。而类器官因其在体外重建人类组织微结构、代谢网络与信号通路的能力,已成为替代动物实验的关键模型,截至2024年初,全球已有106项临床研究直接应用类器官模型。
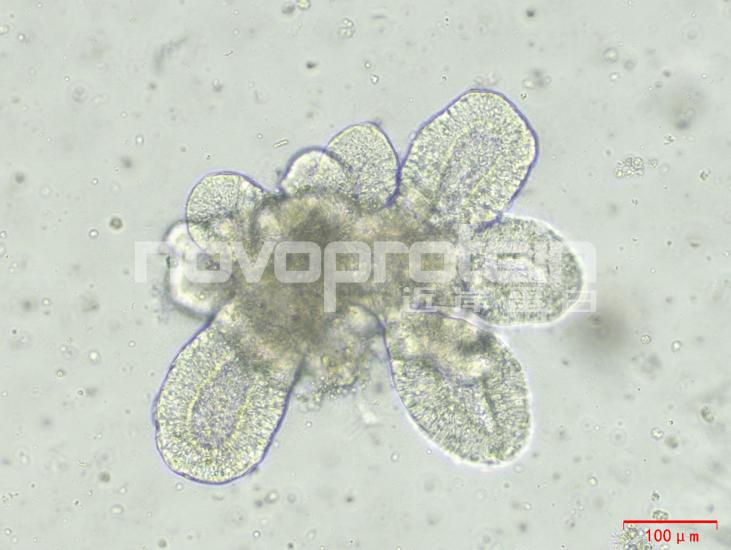
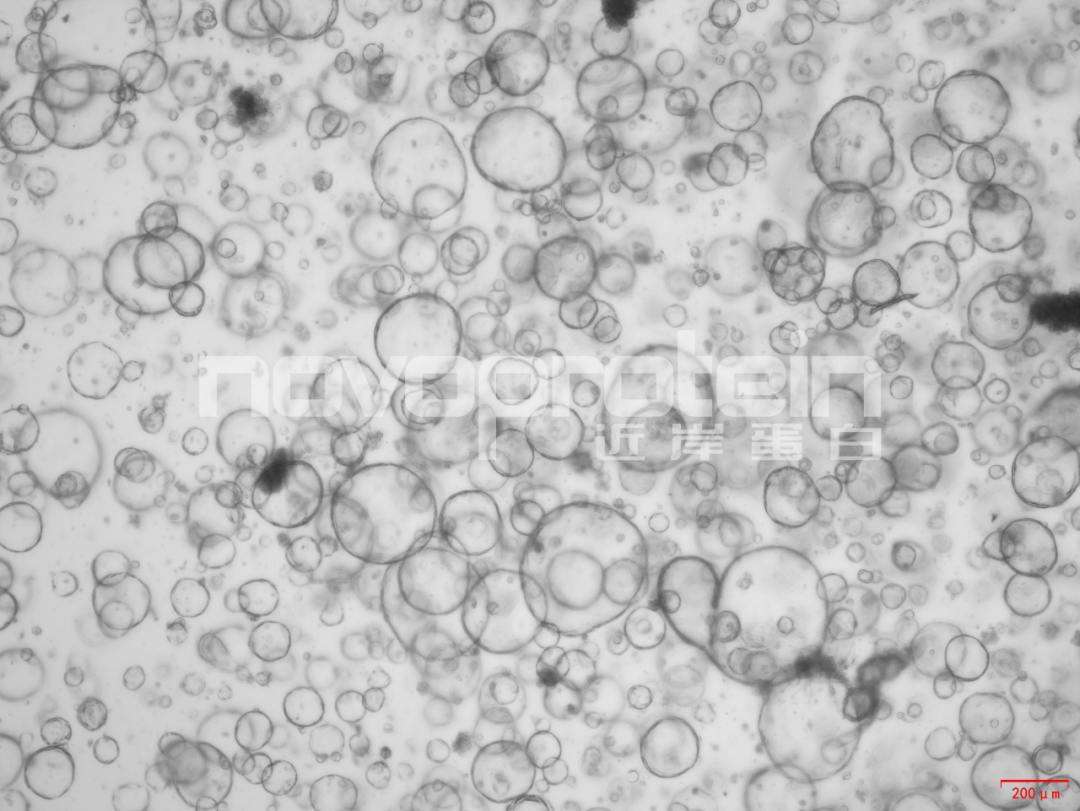
图:经近岸蛋白细胞因子验证培养的类器官(从左至右,从上至下:乳腺癌类器官、ipsc来源的人小肠类器官、小鼠胃类器官及小鼠胆管类器官)
在政策的扶持与技术的突破下,近年来,类器官技术已经从实验室原型逐步走向系统化、规模化阶段,正成为全球生物医药领域增长最快的技术板块之一。2024 年,ATCC发布15种认证类器官细胞系,确立了国际质量基准;全球已有12家CRO机构提供GMP级筛选服务,美国和欧洲相继启动类器官数据监管指南与产业合作计划,尤其美国FDA与EMA均已发布政策,逐步接纳类器官数据作为临床前评价的重要依据。根据Astute Analytica 2025年报告,2024年全球类器官与球状体市场规模约10.7亿美元,预计2033年将突破66亿美元,年均复合增长率高达 22.4%。
在这一宏观背景下,UCSD团队的CANDiT研究正代表着类器官与人工智能结合的方向性成果:通过机器学习解析分化网络,再以PDO体系验证“细胞命运重编程”,真正实现了计算推理到生物验证的闭环。这意味着,类器官正在超越其“药筛模型”的角色,成为探索癌症分化、重建细胞命运与实现个体化治疗的核心载体。
未来,这一框架若能在临床中验证,将标志着分化疗法从理论走向实践。“CANDiT+类器官”的模式更是有望成为推动“可计算分化医学”发展的核心框架,为更多实体瘤的诊治带去新的希望。
近岸蛋白相关产品
近岸蛋白依靠专业的研发团队,精心打造类器官验证平台,可提供一系列经验证、高活性、高稳定性的类器官培养产品,助您高效快速开展类器官实验!
NovoMatrix-经类器官培养验证的基质胶
近岸蛋白提供经类器官/干细胞培养验证的系列NovoMatrix基质胶,产品批次稳定可控,让您的类器官/干细胞培养更可控!
NovoMatrix支持多种类器官培养
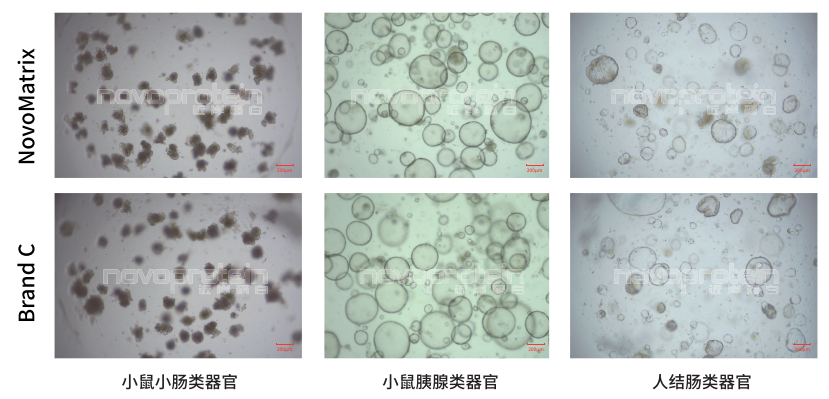
NovoMatrix Organoid Validated,GFR,Phenol Red-Free (Cat.No.:NMO-G005-PF) and a similar product of Brand C were used for culture of different organoid models
NovoMatrix支持类器官稳定传代

NovoMatrix Organoid Validated,GFR,Phenol Red-Free (Cat.No.:NMO-G005-PF) maintain stable passage of organoids comparable to a similar product of Brand C
经类器官培养验证的细胞因子
近岸蛋白自主研发生产并经过类器官培养验证的低内毒素Activin A、BMP-4、EGF、FGF-7、FGF-10、FGFb、FGF8b、HGF、IGF1、Noggin、NRG1、R-Spondin 1/3和Wnt3a等细胞因子,已经在人肿瘤类器官如垂体瘤类器官、脑膜瘤类器官、乳腺癌类器官,人正常类器官如ipsc来源的人小肠类器官,以及小鼠正常类器官如小肠类器官、结肠类器官、胃类器官以及胆管类器官等体外模型上进行了验证。
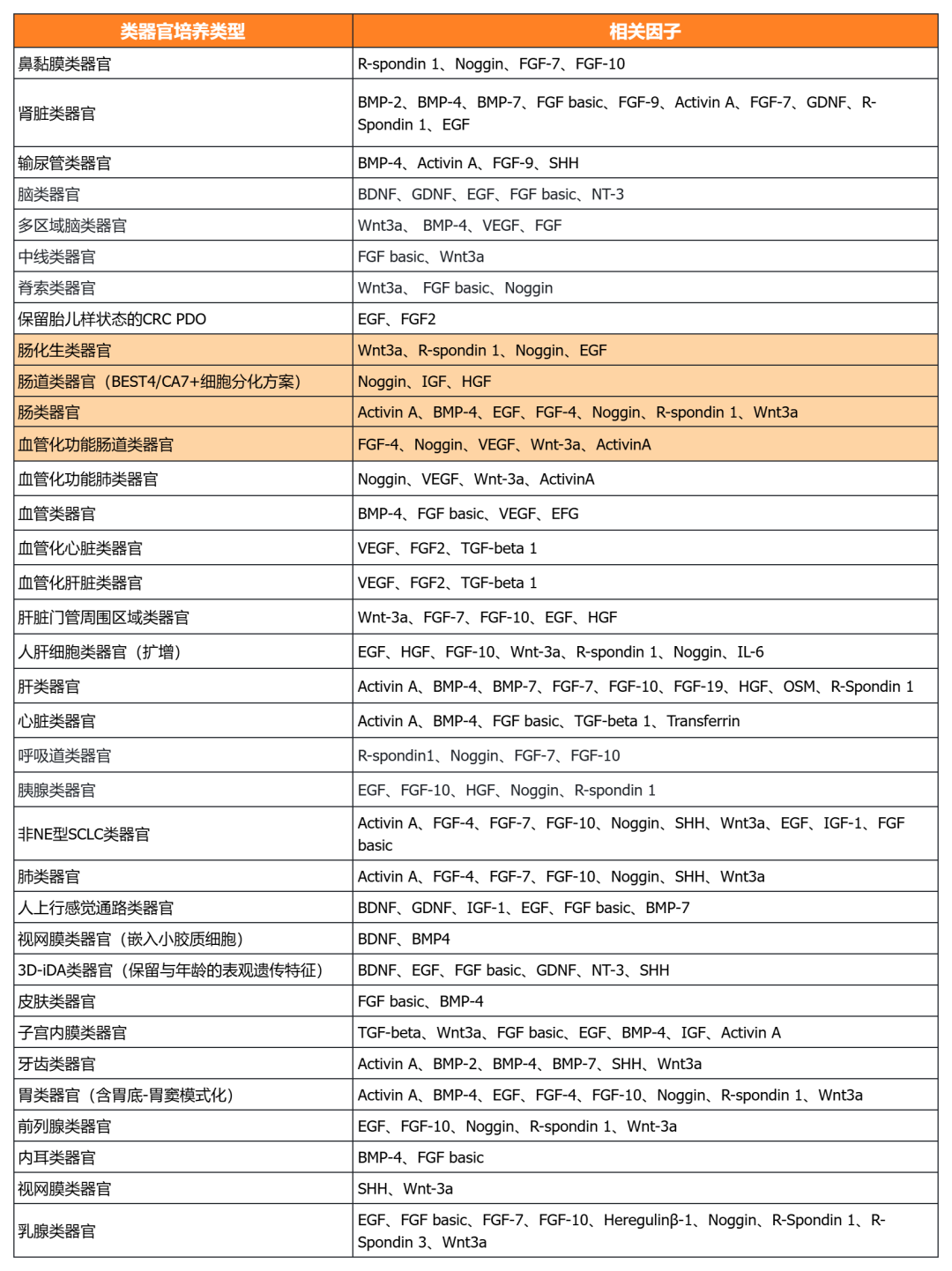
经类器官培养验证的完全培养基
参考资料
Sinha S, Alcantara J, Perry K, et al. CANDiT: A machine learning framework for differentiation therapy in colorectal cancer. Cell Rep Med. Published online October 20, 2025. doi:10.1016/j.xcrm.2025.102421
